Ácido y de base
 La primera definición moderna de ácidos y bases se debe al químico sueco Svante Arrhenius (1859-1927), que definió los ácidos como las sustancias que aumentan la concentración de iones hidronio (H30–) en disolución acuosa, y las bases como las sustancias que aumentan la concentración de iones oxhidrilo (OH–) en disolución acuosa.
La primera definición moderna de ácidos y bases se debe al químico sueco Svante Arrhenius (1859-1927), que definió los ácidos como las sustancias que aumentan la concentración de iones hidronio (H30–) en disolución acuosa, y las bases como las sustancias que aumentan la concentración de iones oxhidrilo (OH–) en disolución acuosa.
Así, por ejemplo, el ácido nítrico (HN03) es un ácido porque en disolución acuosa reacciona del modo siguiente:
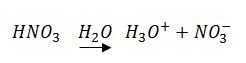
Análogamente, el hidróxido de potasio (KOH) es una base porque en disolución acuosa reacciona así:
![]()
A pesar de que la teoría de Arrhenius explica el comportamiento ácido o básico de un gran número de sustancias, resulta aún muy limitada. Así, por ejemplo, no permite explicar el carácter básico del amoníaco (NH3).
Un enfoque más amplio fue dado por el químico danés Brønsted (1879-1956) y por el químico inglés Lowry (18744936), quienes definieron un ácido como aquella sustancia capaz de ceder un protón a otra sustancia, y una base como aquella sustancia capaz de aceptar un protón de un ácido.
Es decir, un ácido es un dador de protones y una base es un receptor de protones.
La teoría de Brønsted y Lowry permite subsanar el problema que planteaba el comportamiento del amoniaco. En efecto, las soluciones acuosas de amoníaco son básicas, puesto que el agua actúa como un ácido, cediendo un protón a la molécula de NH3, que actúa como una base:
![]()
En general, Cualquier reacción ácido-base, según la teoría de Brønsted y Lowry, puede representarse del modo siguiente:
![]()
donde el ácido A y la base A representan un par conjugado, y el ácido B y la base B representan otro par conjugado.
Los miembros de un par conjugado únicamente difieren en un protón. Se dice que un ácido es fuerte cuando su base conjugada es débil. Análogamente, una base es fuerte cuando su ácido conjugado es débil. Las sustancias que, como el agua, pueden comportarse indistintamente como ácidos o como bases reciben el nombre de antipróticas o anfóteras.
