Ley de las proporciones definidas
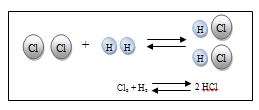
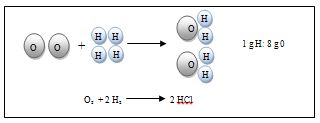
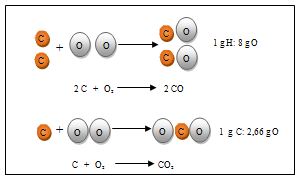
 Esta ley fue establecida por el químico francés Proust (1754-1826) y se enuncia del modo siguiente: si dos o más elementos químicos se combinan para formar un compuesto químico lo hacen siempre en la misma relación en peso. Así, por ejemplo, para formar el agua la relación de la masa de hidrógeno con la masa de oxígeno es siempre 1/8.
Esta ley fue establecida por el químico francés Proust (1754-1826) y se enuncia del modo siguiente: si dos o más elementos químicos se combinan para formar un compuesto químico lo hacen siempre en la misma relación en peso. Así, por ejemplo, para formar el agua la relación de la masa de hidrógeno con la masa de oxígeno es siempre 1/8.
Es decir, que en el agua hay siempre un 11,11% de hidrógeno en peso y un 88,88% de oxígeno.
Por tanto, si se descompusieran 9 g de agua se obtendrían 8 g de oxígeno y 1 g de hidrógeno. Si se hicieran reaccionar 16 g de oxígeno y 3 g de hidrógeno se formarían 18 g de agua provenientes de la reacción de 16 g de oxígeno y 2 g de hidrógeno, y quedaría 1 g de hidrógeno sin reaccionar.
En este caso el oxígeno sería el reactivo limitante. Por el contrario, si se hicieran reaccionar 17 g de oxígeno y 2 g de hidrógeno. Se formarían 18 g de agua obtenidos al reaccionar 16 g de oxígeno y 2 g de hidrógeno, y quedaría 1 g de oxígeno sin reaccionar. En este caso el hidrógeno seria el reactivo limitante.