Las aleaciones de Fe-C constituyen la familia de materiales de mayos importancia por su aplicación y por su versatilidad.
Dentro de estas aleaciones se distinguen dos tipos fundamentales: Menos del 2% de C aceros al carbono
Más del 2% de C fundición o hierro colado.
Las aleaciones de Fe-C para pequeños % de C en los que se incluyen todos los aceros al carbono, no se encuentran en equilibrio ya que solidifican dando como resultado estructuras de cementita: compuesto intermetálico de Fe-C de fórmula Fe3C, que no corresponde a la estructura del sistema de menor energía.
Aleaciones con mayor porcentaje de C pueden conseguir las estructuras de equilibrio si la aleación se enfría muy lentamente y se añade durante la solidificación Si o C en forma de pequeñas partículas sólidas, en estas condiciones las fundiciones pueden dar estructuras en las que en lugar de cementita aparezca el grafito.
También mediante tratamiento térmico de fundiciones de cementita se pueden obtener fundiciones con grafito, por tanto, en el diagrama de equilibrio Fe-C hay que distinguir dos diagramas: el de Fe-grafito, que es el de equilibrio pero para el caso de los aceros no proporciona las estructuras que realmente presentan éstos, y el de Fe- Fe3C, que presenta las estructuras de los aceros y de las fundiciones blancas (fundiciones con cementita) a diferencia de las grises (grafito).
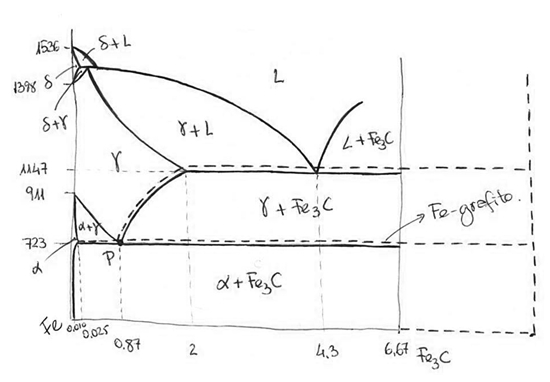
En el diagrama se ha representado mediante línea continua el sistema Fe-Fe3C. La línea discontinua presenta las variaciones que con respecto al diagrama de Fe-Fe3C (cementita) presenta el diagrama Fe-grafito.
La línea discontinua presenta las variaciones que con respecto al diagrama de Fe-Cementita (Fe3C) presenta el de Fe-Grafito.
El C forma con el Fe en estado sólido una solución sólidaα intersticialδ. Presenta tres formas alotrópicas si bien dos de ellas, la y la , son las mismas y en algunos aceros aleados no hay separación entre ellas.
Hasta 911ºC la fase α-BCC que admite muy poco C disuelto (a efectos prácticosα para cálculo de fases en zonas bifásicas, la solubilidad de C en Fe- se puede considerar cero).
A 768ºC el Fe deja de ser magnético; esta temperatura se conoce como punto de Curie.
De 911 a 1398ºC el Fe es FCC; se conoce como Fe-γ o austenita. Admite un máximo de 2% de C intersticial a la temperatura de 1147ºC.
Desde 1398 hasta 1536ºC el Fe vuelve a ser BCC.
El diagrama a temperaturas altas presenta un peritéctico con 0,16% de C y a una temperatura superior a 1400ºC.
Debido a la elevada temperatura a la que se produce, la segregación química que se pueda producir como consecuencia del peritéctico desaparece ya que a temperaturas tan elevadas se produce rápidamente la homogenización del grano; de forma que para los aceros, que
son aleaciones con menos de 2% de C, su estructura y propiedades, que dependen de su historia térmica y mecánica, desdeγ el punto de vista térmico sólo interesa lo que suceda desde la fase hacia temperaturas más bajas.
Para la región de los aceros presenta especial interés el punto eutectoide “P” que se conoceα como perlita. Está constituido por laminillas alternadas de Fe- (Ferrita) y de cementita. Mediante tratamientos térmicos, esta perlita laminar puede transformarse en perlita globular, en la cual en lugar de laminillas aparecen pequeños glóbulos de cada una de las fases.
Fuente: Apuntes de Ciencia de Materiales. Ingeniería Química – Universidad de Huelva
