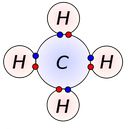
 En muchas ocasiones la formación de una sustancia iónica no resulta favorable desde el punto de vista energético. En estos casos se forma un enlace covalente como resultado de una compartición de electrones entre los átomos que se enlazan. La estabilidad del enlace covalente proviene de la disminución energética que experimentan los átomos al enlazarse. La formación del enlace covalente se explica mediante dos teorías: la teoría del enlace de valencia y la teoría del orbital molecular.
En muchas ocasiones la formación de una sustancia iónica no resulta favorable desde el punto de vista energético. En estos casos se forma un enlace covalente como resultado de una compartición de electrones entre los átomos que se enlazan. La estabilidad del enlace covalente proviene de la disminución energética que experimentan los átomos al enlazarse. La formación del enlace covalente se explica mediante dos teorías: la teoría del enlace de valencia y la teoría del orbital molecular.
En la teoría del enlace de valencia se supone que el enlace se forma cuando dos átomos se acercan lo suficiente para lograr una adecuada superposición de sus orbitales externos.
En muchos casos, el uso de orbitales atómicos puros no esta de acuerdo con los hechos experimentales. Para eliminar esta discrepancia entre la teoría y la experimentación, en muchos compuestos es necesario suponer que durante el proceso de formación del enlace se produce una hibridación o mezcla de orbitales puros.
Así, por ejemplo, cuando se hibridan un orbital s puro y un orbital p puro se forman dos orbitales sp2 híbridos, como los queintervienen en la formación del acetileno. Cuando se hibridanun orbital s puro con dosorbitales p puros se forman 3orbitales sp2 híbridos, como losque intervienen en la formacióndel etileno.
Cuando se hibridanun orbital s puro con 3orbitales p puros se forman 4orbitales sp2 híbridos, como losque intervienen en la formaciónde la molécula de etano.Existen también otros tipos dehibridación que implicanorbitales d dsp2, dsp2, d2sp2, etcétera. Se denomina enlace a cualquier enlace en que losorbitales de unión sesuperponen a lo largo del ejeinternuclear.
Por el contrario, sedenomina enlace π a cualquierenlace en que los orbitales deenlace se superponen porencima y por debajo del ejeinternuclear. En la teoría delorbital molecular se supone quelos núcleos de los átomosenlazados se encuentran ya ensu distancia internuclear deequilibrio, libres de todos suselectrones.
Esta estructuraposee orbitales moleculares dediversos nivelesenergéticosformados a partir delos orbitalesatómicos. Loselectrones se vansituando en dichosorbitales molecularesobteniéndose de estemodo laconfiguraciónelectrónica de lamolécula.Un tipo especial deenlace covalente esel coordinado odativo, en el que un par deelectrones de un átomo soncompartidos por dos átomos:
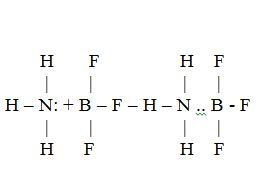
Se dice que un enlace covalente es apolar cuando los dos átomos que se enlazan atraen por igual a los electrones compartidos. En cambio, se dice que un enlace covalente es polar cuando los átomos que se enlazan atraen de modo diferente a los electrones compartidos.
Se denomina electronegatividad ala tendencia que tiene un átomo que forma parte de un enlace a atraer hacía si los electrones compartidos. Cuanto mayor es la diferencia de electronegatividades entre los átomos que se enlazan, tanto mayor es la polaridad de un enlace covalente.
