 Cuando los átomos reaccionan para formar enlaces únicamente actúan los electrones del nivel más externo, denominado nivel de valencia. Para representar los electrones del nivel de valencia se usa la notación de Lewis, así llamada en honor del físico estadounidense Lewis (18754946), que consiste en escribir los símbolos atómicos rodeados de tantos puntos como electrones tenga el átomo en el nivel de valencia.
Cuando los átomos reaccionan para formar enlaces únicamente actúan los electrones del nivel más externo, denominado nivel de valencia. Para representar los electrones del nivel de valencia se usa la notación de Lewis, así llamada en honor del físico estadounidense Lewis (18754946), que consiste en escribir los símbolos atómicos rodeados de tantos puntos como electrones tenga el átomo en el nivel de valencia.
El enlace iónico
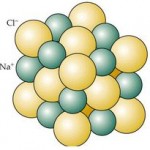
Un enlace iónico es el que se forma por transferencia de uno o varios electrones desde el nivel de valencia de un átomo al nivel de valencia de otro.
El átomo que pierde electrones se convierte en un catión, mientras el que los gana se convierte en un anión. El enlace iónico se produce por la atracción electrostática entre los iones de carga opuesta.
Una configuración electrónica muy estable para los átomos consiste en tener 8 electrones en el nivel de valencia. La tendencia a alcanzar esta configuración se conoce como regla del octete.
La estabilidad de las sustancias iónicas se debe al desprendimiento de una gran cantidad de energía, denominada energía reticular, al formarse el sólido iónico.
