El estado de equilibrio de un sistema químico reaccionante viene dado por un equilibrio dinámico en el cual las velocidades de reacción directa e inversa de los dos procesos opuestos son iguales. Ahora bien, como la ley de acción de masa permite determinar dichas velocidades en función del producto de las concentraciones de las sustancias que intervienen en la transformación, bastará con igualar las expresiones obtenidas para deducir la ecuación de equilibrio del sistema reaccionante.
El estado de equilibrio de un sistema químico reaccionante viene dado por un equilibrio dinámico en el cual las velocidades de reacción directa e inversa de los dos procesos opuestos son iguales. Ahora bien, como la ley de acción de masa permite determinar dichas velocidades en función del producto de las concentraciones de las sustancias que intervienen en la transformación, bastará con igualar las expresiones obtenidas para deducir la ecuación de equilibrio del sistema reaccionante.
En efecto, consideramos la reacción general:
![]()
Las velocidades de la reacción directa, vd, y de la reacción inversa, v, pueden expresarse como:
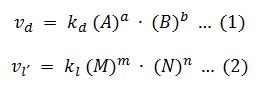
Y en el momento en que se alcance el equilibrio, vd = vl∙
Por consiguiente, igualando las ecuaciones (1) y (2) resultará:
Kd (A)a ∙ (B)b … = kl (M)m · (N)n … (3)
de donde se obtiene:
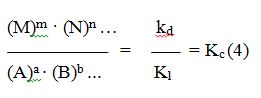
El cociente kd /kl de las dos constantes de velocidad es otra constante, que únicamente depende de la temperatura y que se denomina constante de equilibrio Kc.
En el caso de que la reacción tenga lugar de fase gaseosa, en vez de emplearse las concentraciones deben emplearse las presiones parciales, representándose la constante de equilibrio por kp.
Es decir,
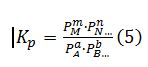
Kp y Kc están relacionados por una sencilla expresión. En efecto, aplicando la ecuación general de los gases ideales a cualquier gas de la mezcla se tiene que
de donde (7); pero como nl/V = cl (8), sustituyendo (8) en (7) resulta
(9), y sustituyendo (9) en (5) se obtiene la expresión:
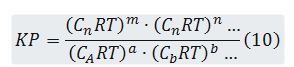
Es decir,
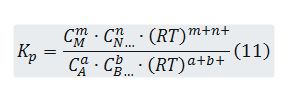
Sustituyendo (4) en (11) resulta:
![]()
donde es el incremento en el número de moles gaseosos correspondientes al proceso.