En este enlace, de los elementos que intervienen uno de ellos tiene tendencia a aceptar electrones y el otro tiene tendencia a cederlos. De esta forma el sistema presenta menor energía y, por tanto, se encuentra en equilibrio.
Como consecuencia del carácter no neutro y de signo contrario de cada uno de los iones que participan en el enlace, existen fuerzas de atracción electrostáticas que provocan que los iones se aproximen unos a otros.
Por otra parte, existen fuerzas de repulsión que impiden que los iones se superpongan uno sobre el otro. La fuerza de atracción entre dos cargas, Z1e y Z2e, viene dada por:
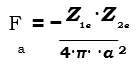
La fuerza de repulsión en general viene dada por una ecuación del tipo:
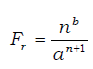
a ≡ distancia entre iones.
n,b ≡ coef. característicos de los elementos que se enlazan.
Como consecuencia de estas dos fuerzas contrarias, los iones alcanzarán un estado de equilibrio cuando la resultante de las fuerzas que actúan sobre ellos sea cero: Fr + Fa = 0
Este equilibrio corresponde a un valor de “a” que, considerando que los iones son bolas duras, será igual al valor del radio iónico de A más el radio iónico de B, siendo A y B los elementos a enlazar para dar AB.
Los radios iónicos son distintos de los radios atómicos
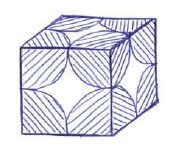
Cuando el enlace iónico da lugar a un sólido en estado cristalino, esto supone que para un compuesto tal como AB, los iones de A y de B se sitúan en el espacio en posiciones relativas bien determinadas, de forma que el ión de una especie está rodeado siempre por un número determinado de iones de la otra especie.
Por ejemplo, una disposición muy común es aquella en la que los iones B se ubican en los vértices de un cubo. Un cristal de este tipo está formado por la repetición triplemente periódica en el espacio de esta figura elemental que se conoce como celda unitaria.
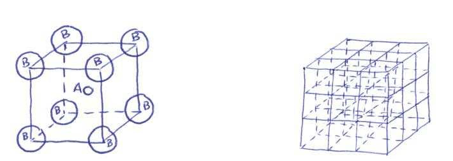
En esta disposición, de acuerdo con el modelo de bolas duras, los iones B están en contacto tangencial, colocándose el ión A en el hueco existente en el centro del cubo que han dejado los contactos de los iones B.
Fuente: Apuntes de Ciencia de Materiales. Ingeniería Química – Universidad de Huelva
