Los enlaces iónico, covalente y metálico se caracterizan por tener una elevada energía de enlace. Sin embargo, existen otros tipos de enlaces cuya energía es mucho menor: los enlaces secundarios.
El enlace de Van der Waals se debe a unas débiles fuerzas de atracción electrostática; cuando las moléculas que se enlazan, si bien no son neutras desde el punto de vista eléctrico, no tienen centradas las cargas positiva y negativa, pudiendo dar lugar a un dipolo eléctrico en el que la carga negativa desplazada de una de las moléculas atrae a la positiva de la otra con más fuerza que la fuerza de repulsión entre cargas del mismo signo. Un caso particular de este tipo de enlaces se da en algunos polímeros, como es el caso del poli cloruro de etileno:
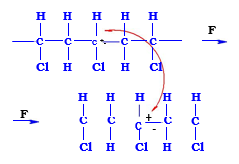
En el que entre dos cadenas poliméricas presentan entre átomos alternos de carbono enlaces uno con H y otro con Cl. El Cl aporta “negatividad” y el H “positividad” de carga.
Como consecuencia de esta situación, sobre ese en lace, la carga negativa está más desplazada hacia el Cl, la positiva hacia el H y, si las dos macromoléculas se disponen tal y como se presenta en el esquema, de forma que el H correspondiente al C con enlaces H-Cl se enfrente al Cl de la otra macromolécula, existe la atracción entre carga positiva y carga negativa tal y como se representa. (También existen fuerzas de repulsión pero son minoritarias).
Existe una débil fuerza de atracción que es suficiente para mantener a las macromoléculas en posiciones relativas fijas (no se mueven libremente una respecto a la otra gracias a dicha atracción).
Sin embargo, el enlace es muy débil y la aplicación de fuerzas que provoquen la separación entre estas moléculas da lugar a que se deslicen fácilmente unas sobre otras. Esto dota a este tipo de materiales de una gran capacidad de deformación plástica.
Fuente: Apuntes de Ciencia de Materiales. Ingeniería Química – Universidad de Huelva