Entre los conceptos más importantes de la termodinámica destaca el de la entropía, que puede definirse como una medida del desorden. De este modo, si por ejemplo todas las moléculas de aire contenidas en una habitación se encontrasen inicialmente en una esquina, se repartirían uniformemente, siendo prácticamente imposible que se verifique el proceso contrario, es decir, que las moléculas de aire de la habitación se encuentren por si solas en una de sus esquinas.
Entre los conceptos más importantes de la termodinámica destaca el de la entropía, que puede definirse como una medida del desorden. De este modo, si por ejemplo todas las moléculas de aire contenidas en una habitación se encontrasen inicialmente en una esquina, se repartirían uniformemente, siendo prácticamente imposible que se verifique el proceso contrario, es decir, que las moléculas de aire de la habitación se encuentren por si solas en una de sus esquinas.
Esto significa que la entropía nunca disminuye durante los cambios de estado del sistema.
Asimismo, cuanto mayor es el desorden tanto mayor es la entropía del sistema, es decir, la entropía de un sólido cristalino es menor que la de dicha sustancia fundida, ya que en dicho estado las moléculas no están situadas en posiciones fijas de la red cristalina, sino que se mueven con un grado mayor de libertad, siendo mayor el desorden.
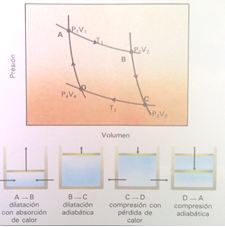
La expresión termodinámica que nos permite determinar las variaciones de la entropía de un sistema en el que se verifica una transformación reversible es la siguiente: dS = dQ/T donde dS representa la variación de la entropía buscada, mientras que dQ es la cantidad de calor y T es la temperatura absoluta.
En los sistemas aislados la entropía total aumenta siempre en los procesos irreversibles, lo que hace que la energía disponible vaya disminuyendo.
Una vez que el sistema aislado ha alcanzado su máxima entropía, es decir que la materia contenida en el sistema se encuentre en un estado de máximo desorden y que la temperatura en el interior de el sea completamente uniforme,
Ya no existe energía libre que permita realizar trabajo alguno, por lo que se dice que se ha alcanzado el estado de muerte entrópica.