Cuando se disuelve en agua un ácido o una base se forman iones H3O+ y OH– que originan el carácter ácido o básico de la disolución. Ahora bien, como el agua pura tiene un comportamiento anfiprótico y se autoioniza según la ecuación.
Cuando se disuelve en agua un ácido o una base se forman iones H3O+ y OH– que originan el carácter ácido o básico de la disolución. Ahora bien, como el agua pura tiene un comportamiento anfiprótico y se autoioniza según la ecuación. ![]()
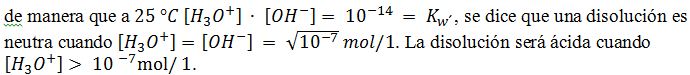
Para expresar [H_3 O^+ ]de una forma más sencilla, el químico danés Sørensen (1868-1939) ideó la escala pH. Se define el pH de una disolución como el logaritmo decimal con el signo cambiado de la concentración de iones H_3 O^+. Es decir, pH =-¬log H_3 O^+. Así pues, en una disolución neutra pH = – log 〖10〗^(-7) = 7; en una disolución ácida pH < 7, y en una disolución básica pH > 7.