Todos los materiales están integrados por átomos los que se organizan de diferentes maneras, dependiendo del material que se trate y el estado en el que se encuentra.
Cuando un material se encuentra en forma de gas, sus átomos están más dispersos o desordenados (a una mayor distancia uno de otro) en comparación con los átomos de ese mismo material pero en estado líquido o sólido.
Existen materiales en los que sus átomos siempre están en desorden o desaliniados aún en su estado sólido, a estos materiales se les llama materiales amorfos, un ejemplo es el vidrio, al que se considera como un líquido solidificado.
En el caso de los metales, cuando estos están en su estado sólido, sus átomos se alinean de manera regular en forma de mallas tridimensionales. Estas mallas pueden ser identificadas fácilmente por sus propiedades químicas, físicas o por medio de los rayos X.
Cuando un material cambia de tipo de malla al modificar su temperatura, se dice que es un material polimorfo o alotrópico.
Los átomos de los metales están ordenados en forma estructurada, esto es en forma de estructuras cristalinas para apreciar de manera mejor daremos algunas definiciones importantes que debemos comprender acerca de los metales:
Estructura Cristalina: se refiere al tamaño, la forma y la organización atómica dentro de la red de un material.
Red: Conjunto de puntos, conocidos como puntos de red, que están ordenados de acuerdo a un patrón que se repite en forma idéntica.
Puntos de Red: Puntos que conforman la red cristalina. Lo que rodea a cada punto de red es idéntico en cualquier otra parte del material.

Celda Unitaria: es la subdivisión de la red cristalina que sigue conservando las características generales de toda la red.
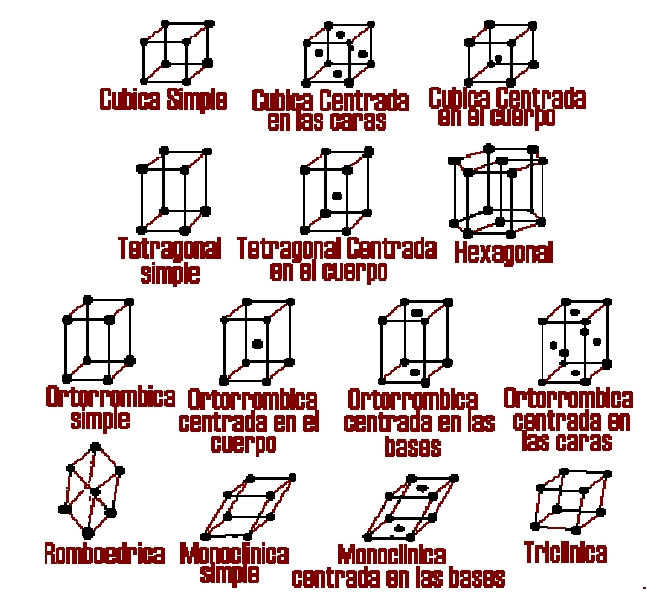
Parámetro de Red (ao): Longitudes de los lados de las celdas unitarias y los ángulos entre estos lados.
Número de Coordinación: el numero de átomos que tocan a otro en particular, es decir el numero de vecinos mas cercanos, indica que tan estrechamente están empaquetados los átomos.
La malla cúbica de cuerpo centrado es la estructura que tiene el hierro a temperatura ambiente, se conoce como hierro alfa. Tiene átomos en cada uno de los vértices del cubo que integra a su estructura y un átomo en el centro. También se encuentran con es ta estructura el cromo, el molibdeno y el tungsteno.
La malla cúbica de cara centrada aparece en el hier ro cuando su temperatura se eleva a aproximadamente a 910ºC, se conoce como hierro gamma. Tiene átomos en los vértices y en cad a una de sus caras, su cambio es notado además de por los rayos X por l a modificación de sus propiedades eléctricas, por la absorción de calor y por las distancias intermoleculares. A temperatura elevada el aluminio, la plata, el cobre, el oro, el níquel, el plomo y el platino son algunos de los metales que tienen esta estructura de malla.
La malla hexagonal compacta se encuentra en metales como el berilio, cadmio, magnesio, y titanio. Es una estructura que no permite la maleabilidad y la ductilidad, es frágil.
Modificar a una malla de un metal permite la participación de más átomos en una sola molécula, estos átomos pueden se r de un material aleado como el carbón en el caso del hierro, lo que implica que se puede diluir más carbón en un átomo de hierro.
Si se tiene en cuenta que el carbón es el que, en ciertas proporciones, da la dureza al hierro, entonces lo que se hace al cambiar la estructura del hierro es permitir que se diluya más carbón, con lo que se modifican sus propiedades.
Otra de las características de los metales que influye notablemente en sus propiedades es el tamaño de grano, el cual depende de la velocidad de enfriamiento en la solidificación del metal, la extensión y la naturaleza del calentamiento que sufrió el metal al ser calentado.
Indica que tanto se deforma cada unidad del material para un esfuerzo aplicado.
