Cuando dos o más gases que no reaccionan químicamente se colocan en un mismo recipiente, la presión que ejerce cada gas en la mezcla es la misma que ejercería si él sólo ocupara todo el recipiente. La presión que ejerce cada gas en una mezcla se llama presión parcial y, tal como observó John Dalton (1766-1844), la presión que ejerce una mezcla de gases es igual a la suma de las presiones parciales de cada gas en la mezcla.
Cuando dos o más gases que no reaccionan químicamente se colocan en un mismo recipiente, la presión que ejerce cada gas en la mezcla es la misma que ejercería si él sólo ocupara todo el recipiente. La presión que ejerce cada gas en una mezcla se llama presión parcial y, tal como observó John Dalton (1766-1844), la presión que ejerce una mezcla de gases es igual a la suma de las presiones parciales de cada gas en la mezcla.
Se llama difusión a la capacidad de un gas para mezclarse espontáneamente y esparcirse a través de otro gas.
Thomas Graham (1805-1869) demostró que las velocidades de difusión de los gases son inversamente proporcionales a las raíces cuadradas de sus densidades. Matemáticamente esto puede expresarse como:
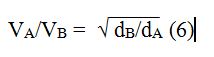
donde VA y VB son, respectivamente, las velocidades de difusión de los gases A y B, y dA y dB sus densidades respectivas.
Teoría cinética de los gases
El hecho de que todos los gases muestren un comportamiento análogo y cumplan las mismas leyes se explica adecuadamente mediante la teoría cinética molecular.