 Es un gas incoloro, inodoro e insípido que constituye el 78% en volumen de la atmósfera. También se encuentra combinado en forma de nitratos de sodio y de potasio. Es un elemento esencial de las proteínas de todos los animales y plantas. Se obtiene a partir del aire, por eliminación del oxígeno. En el laboratorio se aísla haciendo pasar aire por encima de cobre calentado al rojo, que se combina con el oxígeno para formar óxido cúprico, CuO.
Es un gas incoloro, inodoro e insípido que constituye el 78% en volumen de la atmósfera. También se encuentra combinado en forma de nitratos de sodio y de potasio. Es un elemento esencial de las proteínas de todos los animales y plantas. Se obtiene a partir del aire, por eliminación del oxígeno. En el laboratorio se aísla haciendo pasar aire por encima de cobre calentado al rojo, que se combina con el oxígeno para formar óxido cúprico, CuO.
Industrialmente el nitrógeno se obtiene por destilación fraccionada del aire líquido. El nitrógeno es un elemento muy inactivo. Pero cuando se calienta a elevadas temperaturas se combina con algunos metales para formar nitruros, como el Mg3N2 o el Ca3N2.
Se usa en grandes cantidades para obtener abonos nitrogenados, puesto que el nitrógeno es un nutriente esencial de todos los organismos vivos.
Aunque las plantas no pueden asimilar el nitrógeno atmosférico, las bacterias nitríficantes fijan el nitrógeno libre convirtiéndolo en compuestos nitrogenados que son asimilados por las plantas y transformados en proteínas.
Los animales herbívoros convierten las proteínas vegetales en proteínas animales y los residuos, tanto de los animales como de las plantas, se convierten en derivados nitrogenados que son transformados en nitrógeno libre por la acción bacteriana. Toda esta serie de transformaciones recibe el nombre de ciclo del nitrógeno.
Amoniaco
El amoníaco (NH3) se produce en la naturaleza por acción de las bacterias de la putrefacción sobre la materia orgánica del suelo. En el laboratorio, el amoníaco se obtiene calentando una sal amónica con hidróxido de sodio o hidróxido de calcio. Industrialmente el amoníaco se obtiene por acción directa del hidrógeno y del nitrógeno según el procedimiento ideado por el químico alemán Haber (18681934), basado en la reacción de equilibrio:
![]()
El rendimiento del proceso disminuye al aumentar la temperatura, pero a bajas temperaturas la reacción es demasiado lenta. La reacción se favorece aumentando la presión y utilizando catalizadores adecuados. El amoníaco es un gas incoloro, de olor picante y muy soluble en agua. El amoníaco líquido se utiliza en máquinas frigoríficas y en la fabricación del hielo.
Óxidos del nitrógeno
El óxido nitroso, N20, se conoce vulgarmente con el nombre de gas hilarante, puesto que produce un estado de excitación histérica acompañado de efectos anestésicos cuando se respira durante un rato, se obtiene al calentar el nitrato de amonio:

El óxido nítrico, NO, se obtiene industrialmente a partir del amoníaco, según el procedimiento ideado por el químico alemán Ostwald (18534932). Para ello se hace pasar una mezcla de aire y amoníaco sobre una malla de contacto de platino a unos 900 °C de temperatura. El platino actúa como catalizador, absorbiendo los gases en su superficie y facilitando el contacto entre los reaccionantes. La reacción que tiene lugar es:
![]() El trióxido de dinitrógeno, N2O3, tan solo existe puro en estado sólido y a bajas temperaturas. Aumentando la temperatura se disocia según la reacción:
El trióxido de dinitrógeno, N2O3, tan solo existe puro en estado sólido y a bajas temperaturas. Aumentando la temperatura se disocia según la reacción:
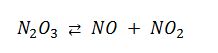
El dióxido de nitrógeno, NO2, y el tetraóxido de dinitrógeno, N2O4, pueden considerarse como la forma monómera y dimera de una misma sustancia. El dióxido de nitrógeno en estado puro se obtiene calentando los nitratos de los metales pesados:
![]()
La molécula de NO2 se dimeriza con gran facilidad:
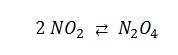 El pentaóxido de dinitrógeno es un sólido incoloro que se obtiene por deshidratación del ácido nítrico con P2O5:
El pentaóxido de dinitrógeno es un sólido incoloro que se obtiene por deshidratación del ácido nítrico con P2O5:
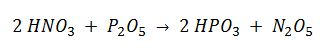 Oxoácidos del nitrógeno
Oxoácidos del nitrógeno
El ácido hiponitroso, H2N2O2, es un sólido cristalino, incoloro, higroscópico y muy explosivo que se obtiene a partir de una suspensión etérea de hiponitrito de plata, Ag2N2O2, tras posterior saturación con cloruro de hidrógeno, que separa el AgCl y deja disuelto el ácido en el éter, de donde se obtiene por evaporación. El ácido nitroso, HNO2, es inestable y se descompone del modo siguiente:
 El ácido nítrico, HNO3, es un líquido incoloro que se mezcla con el agua en todas proporciones. Es un ácido muy fuerte y de gran poder oxidante. Se usa para fabricar colorantes explosivos, abonos y plásticos. Industrialmente se obtiene por el procedimiento de Ostwald, en el cual, una vez formado el óxido nítrico, tal como se indicó anteriormente, se añade más aire para oxidar el NO a NO2, según la reacción:
El ácido nítrico, HNO3, es un líquido incoloro que se mezcla con el agua en todas proporciones. Es un ácido muy fuerte y de gran poder oxidante. Se usa para fabricar colorantes explosivos, abonos y plásticos. Industrialmente se obtiene por el procedimiento de Ostwald, en el cual, una vez formado el óxido nítrico, tal como se indicó anteriormente, se añade más aire para oxidar el NO a NO2, según la reacción:
 El dióxido de nitrógeno formado se hace reaccionar con agua
El dióxido de nitrógeno formado se hace reaccionar con agua
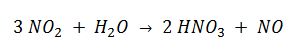 y el NO vuelve a la cámara de reacción, donde se oxida de nuevo a NO2.
y el NO vuelve a la cámara de reacción, donde se oxida de nuevo a NO2.
