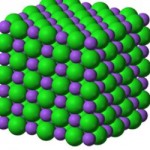
 Aunque el enlace iónico y el enlace covalente determinan la reactividad química de las sustancias, hay otras fuerzas de atracción más débiles entre los átomos y las moléculas que son las responsables de algunas propiedades de los compuestos. El enlace de hidrógeno es la más importante de las fuerzas de atracción débiles y se produce a cuando el hidrógeno está enlazado a un átomo muy electronegativo y de pequeño volumen atómico, como el flúor, el oxígeno o el nitrógeno.
Aunque el enlace iónico y el enlace covalente determinan la reactividad química de las sustancias, hay otras fuerzas de atracción más débiles entre los átomos y las moléculas que son las responsables de algunas propiedades de los compuestos. El enlace de hidrógeno es la más importante de las fuerzas de atracción débiles y se produce a cuando el hidrógeno está enlazado a un átomo muy electronegativo y de pequeño volumen atómico, como el flúor, el oxígeno o el nitrógeno.
En estos casos se forman a moléculas muy polares atraídas entre sí por intensas interacciones dipolares. Los enlaces de hidrógeno son los responsables de la estructura de tipo cristalino del hielo, que hace que éste sea menos denso que el agua líquida, incluso las moléculas polares y los átomos no combinados experimentan fuerzas de atracción débiles, llamadas fuerzas de London, debidas a la creación de dipolos instantáneos originados por el movimiento desordenado de los electrones en los átomos.