Los metales al ser calentados pueden modificar su estado físico pasando por varias etapas, las que van desde la alteración de algunas de sus propiedades hasta en cambio de su estado sólido al líquido.
El qué tan rápido o con qué tanta energía se logra un camb io de estado en un metal dependerá de los materiales que lo integran. Se debe recordar que casi nunca se utilizan metales puros.
A la combinación química de dos o más metales se le llama aleación y las propiedades de las aleaciones dependen también de los metales que la integran.
Algunas de las aleaciones más utilizadas en los pro cesos de manufactura son:
– Latón rojo o amarillo (cobre zinc)
– Bronce (cobre, estaño, zinc, plomo)
– Aluminio, cobre, magnesio, silicio y zinc
– Hierro, carbón, cobalto, tungsteno, vanadio, etc.
– Cobre, oro, plata
Existen tablas y normas internacionales que especifican la nomenclatura y los componentes específicos de cada una de las diferentes aleaciones. Las aleaciones antes señaladas son sólo algunas de las más, existen cientos más de ellas.
Diagramas de Fases con reacciones de tres fases : Muchas aleaciones producen combinaciones de mas de dos fases (binarios). Para el caso de tres fases independientes, cada una de las reacciones puede ser identificada en un diagrama de fase complejo mediante el siguiente procedimiento:
1. Localice las lineas horizontal del diagrama de fases (temperatura a la que ocurre la reacción en condiciones de equilibrio).
2. Localice 3 puntos distintos en la línea, dos extremos y un punto central que representa la composición a la cual ocurre la reacción.
3. Mire arriba del punto central e identifique las fases presentes y luego por debajo del punto central.
4. Compare las fases que identifico con la siguiente tabla.
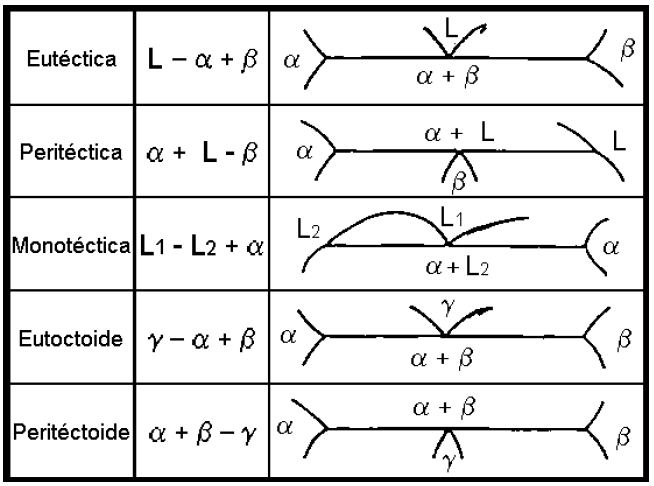
Una de las herramientas que nos permiten conocer de manera sencilla y rápida algunas de las características de las aleaciones son los diagramas de las aleaciones.
Uno de los diagramas de aleaciones más conocido y utilizado del Hierro y el carbono. También conocido como diagrama hierro, hierro, carbono (HHC). Con este diagrama se pueden obtener las temperaturas de cambio de sus estructuras cristalinas; también se pueden conocer las temperaturas a las que se da el cambio de fase de un hierro. En función a la cantidad de carbón que contiene el metal se puede estimar la temperatura a la que se derretirá y a la que se volverá pastoso.
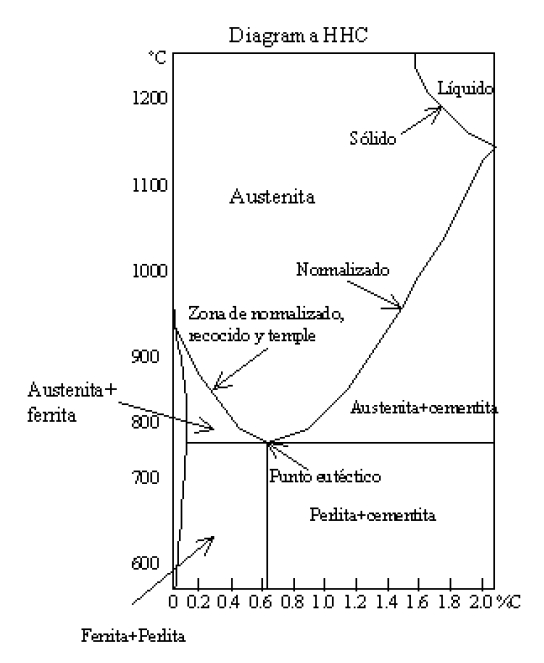
En el eje horizontal del diagrama de Hierro, hierro, carbono se ubica el porcentaje de carbono que puede estar diluido en el hierro y en el eje vertical se señalan las temperaturas a las que van sucediendo los cambios señalados en el cuerpo de la gráfica.
Al conocer la cantidad de carbono que tiene un hierro se pueden estimar la temperatura a la que se debe elevar para que se den los diferentes cambios de estructura o de estado. Por ejemplo si se tiene un hierro con 0.4% de carbón, se deberá elevar su temperatura hasta los 723°C para que el hierro alfa y la perlita empiecen a convertirse en austenita y ferrita.
Aproximadamente a los 800°C es e mismo hierro cambiará su estructura a hierro gamma, en donde su componente principal es la austenita, a los 1480°C empieza a fundirse y arriba de los 1520°C se ha fundido todo.
A los hierros que están debajo de 0.8% de carbón se les llama hipoeutectoides y a aquellos que tienen más de 0.8% de carbón se llaman hipereutectoides. El punto eutéctico es aquel en el que se logra la máxima dilución de carbón posible en un hierro a la menor temperatura. En caso de los hierros con carbón el punto eutéctico se dacon 0.8% de carbón y a 723°C.
Cada vez que se rebasa una zona en la gráfica de HH C, se está cambiando de estructura en el hierro que se está tratando.
Fuente: Materia de Proceso de Manufactura de la Unideg
