Las soluciones sólidas pueden ser de dos tipos:
– Sustitucionales
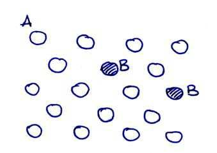
En las soluciones sólidas sustitucionales los átomos de B se colocan sustituyendo algunos átomos de A en la red, tal y como se representa en la figura de la izquierda.
– Intersticiales
Las soluciones sólidas intersticiales son aquellas en las que los átomos de B se colocan en posiciones huecas (no en vacantes) dejadas entre los átomos de A en la red.
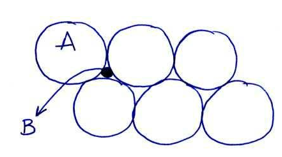
Las soluciones sólidas intersticiales sólo se producen cuando el soluto B tiene un radio atómico muy pequeño. Los átomos que se colocan en los intersticios de la red suelen ser del tipo H, N, C,…
La solubilidad de B en A puede ser total o parcial.
La solubilidad total sólo puede darse en el caso de soluciones sólidas sustitucionales y significa que para cualquier % de B (desde 0% hasta el 100%) los átomos de B se ubican sustitucionalmente en la red de A. La primera condición de solubilidad total es que A y B cristalicen según la misma red.
Para que se produzca solubilidad total tienen que darse cuatro condiciones que se conocen como la Regla de Hume-Rothery:
1) Factor de Tamaño: diferencia de radios iónicos de A y B grandes supone una limitación en la solubilidad, es decir, el porcentaje de la diferencia relativa de radios iónicos debe ser pequeño:
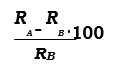
Por encima del 15% la solubilidad es muy limitada.
2) Factor Estructura Cristalina: si a y B poseen el mismo tipo de estructura cristalina se facilita la solubilidad entre ellos.
3) Factor Electronegatividad: cuanto mayor sea la diferencia de electronegatividades de A y B, menor es la solubilidad.
4) Factor Valencia: Cuanto más distintas sean las valencias de A y B menor es la solubilidad.
Estas condiciones sólo expresan la influencia de distintos factores sobre la solubilidad en estado sólido.
Cuando en la red de A sólo se puede disolver hasta, por ejemplo, un 10% de B a una temperatura dada, si hay más de 10% de B, bien s forman además de la solución sólida de B en A otros tipos de cristales (cristales diferentes se forman en distintos granos) o bien se pueden formar otros tipos de estructuras cristalinas sin que aparezca la correspondiente al metal A y, por tanto, sin que aparezca la solución sólida de B en A.
La solubilidad sólida intersticial está limitada por el hecho de que se pueden ir rellenando los huecos dejados por los átomos de A y cuando estos se completen, si se añade más B daría lugar a la deformación de la red de A hasta producir un cambio en ésta.
Con frecuencia los elementos que se disuelven intersticialmente no tienen un tamaño lo suficientemente pequeño como para encajarse en los huecos dejados por los átomos de A, por lo que ya su introducción provoca una cierta deformación en la red.
Existen, por tanto, muchas soluciones sólidas intersticiales en las que el soluto es de lo que teóricamente cabe, pero cuanto mayor sea menor es la solubilidad en dicha red.
Fuente: Apuntes de Ciencia de Materiales. Ingeniería Química – Universidad de Huelva
